肠道菌群还能操控皮肤炎症?清华大学最新Immunity论文,揭示肠道菌群代谢物驱动银屑病炎症的机制
| [日期:2025-09-11] | 作者:生物世界 次浏览 | [字体:大 中 小] |
银屑病(俗称牛皮癣)是一种复杂的炎症性皮肤病,全球约有 3%的人口受其影响。银屑病中慢性皮肤特异性炎症的持续存在依赖于上皮细胞与免疫细胞之间的相互作用以及外部刺激因素的共同作用。
皮肤与免疫细胞协同作用,充当宿主与外部环境之间的屏障。感知病原体以及包括细胞因子、趋化因子和微生物来源的代谢物在内的各种免疫调控因子对于维持皮肤稳态至关重要。然而,持续且不可逆的外部刺激可能会破坏这种免疫平衡,导致慢性炎症(例如银屑病中的症状)。
尽管诸如饮食、吸烟和压力等外部因素可能会促使银屑病的发生和复发,但确切的环境诱因及其调控机制,在很大程度上仍不清楚。
2025 年 9 月 9 日,清华大学基础医学院、清华大学免疫学研究所林欣教授团队在 Cell 子刊 Immunity 上发表了题为:Gut microbe-derived metabolites drive psoriatic inflammation via modulation of skin Th17 cells 的研究论文。
该研究基于团队之前构建的 Card14E138A/+ 自发银屑病小鼠模型,首次揭示了肠道菌群通过代谢色氨酸产生吲哚,并经宿主代谢接力的模式生成硫酸吲哚酚(Indoxyl Sulfate,I3S),进而激活芳香烃受体(AHR)来重塑皮肤 Th17 细胞的表观遗传状态并增强其效应功能,最终远程驱动银屑病炎症。
作为人体最大的器官,皮肤上寄居着种类繁多的微生物群落,这些微生物群落不可避免地会在环境变化或致病条件下发生改变。
与特应性皮炎等病症中明显的皮肤屏障缺陷不同,银屑病患者皮肤微生物群的变化较为细微,这是因为其皮肤屏障大多保持完整。此外,各项研究结果不一致,因此,皮肤微生物群在银屑病发病机制中发挥明确作用的证据有限。这也表明了皮肤微生物群对于银屑病的重要性可能不如之前所假设的那样关键。
与皮肤相比,肠道为微生物群落提供了更适宜的生存环境。肠道微生物群表现出相当大的可塑性,能够适应各种环境因素,并成为影响人类健康的一个关键外部因素。越来越多的研究关注肠道菌群失调与银屑病发病机制之间的相互关系,这一观点得到了临床观察和小鼠模型研究的支持。然而,肠道微生物组固有的个体间差异阻碍了就肠道微生物群与皮肤炎症之间的调控联系得出一致结论的能力。
由于缺乏合适的临床前模型,我们对银屑病发病机制中的环境风险因素的认识仍不全面。通过基因组测序在银屑病患者中定位了众多银屑病易感位点。之前在一名患有严重银屑病的患者身上发现了一个在表皮中主要表达的易感基因 CARD14 的功能获得性突变(c.413A>C [p.Glu138Ala])。
在这项研究中,研究团队构建了 Card14E138A/+ 银屑病小鼠模型,研究团队发现,小鼠模型的自发性皮肤炎症不仅重塑了皮肤免疫结构,还改变了全身代谢物。研究团队进一步鉴定出,肠道(而非皮肤)中产生吲哚的微生物群是银屑病炎症的驱动因子。
从机制上来说,产吲哚肠道微生物通过代谢接力促进宿主生物合成硫酸吲哚酚(I3S)。I3S通过皮肤辅助性 T 细胞 17(Th17)中的芳香烃受体(AHR)信号转导调控染色质可及性,从而加剧皮肤炎症。研究团队进一步在人类银屑病队列中发现,血清 I3S 水平与疾病严重程度呈正相关。
该研究的核心发现:
在银屑病小鼠模型中,肠道微生物(而非皮肤微生物)驱动银屑病炎症;
产吲哚细菌促进宿主 I3S 生物合成,加剧皮肤炎症;
I3S 通过 AHR 依赖性染色质重塑增强皮肤 Th17 细胞反应;
银屑病患者的血清 I3S 水平与疾病严重程度相关。
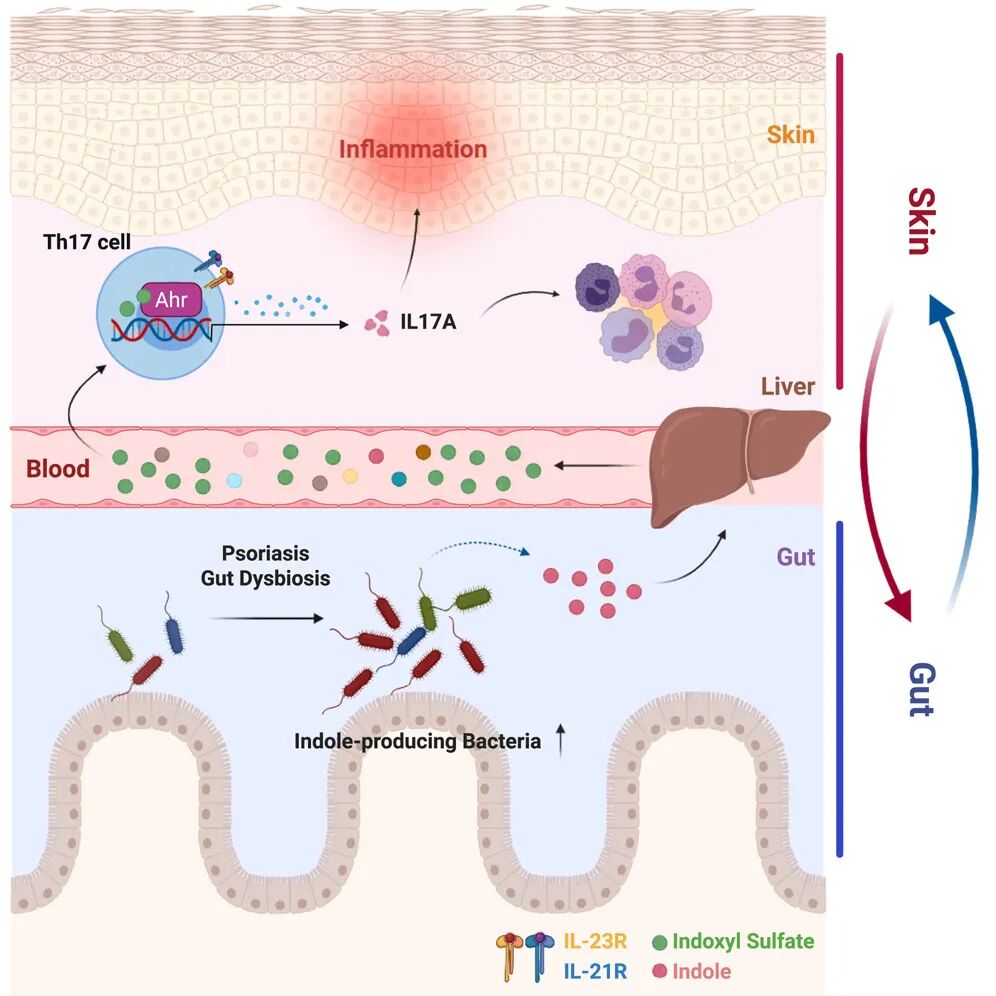
总的来说,该研究揭示了肠道微生物因子与皮肤炎症之间的机制性联系,凸显了微生物群及其代谢物可作为银屑病的潜在治疗靶点。
清华大学基础医学院、清华大学免疫学研究所林欣教授为论文通讯作者,已毕业博士生王晨良、已出站博士后戴尚志(现为北京大学第一医院皮肤科医生)和已毕业博士生张珊珊为论文共同第一作者。